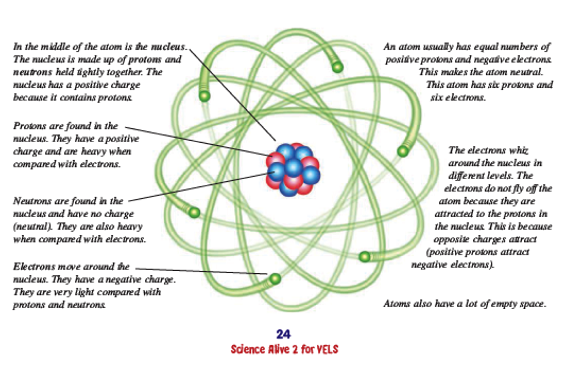
Atomun maddenin en küçük, bölünemeyen parçası olduğu tanımı çoktan hikâye oldu. Ders kitaplarımızda halen geçen bu ifadenin nasıl yalan olduğunun hikayesini sizler için 11 maddede özetledik.
Atomun içinde ne var gelin hep birlikte bakalım.
Atomus, Porthos, Aramis

M.Ö. 440’larda Yunancada “bölünemez” anlamına gelen “atomus” sözcüğünü ilk ortaya atan Demokritos, bunun, maddenin en küçük yapıtaşı olduğunu düşünüyordu. İlkokul ders kitaplarımızı değiştirmekte epey geç kaldığımız kesin, çünkü bilim, yüzyılı aşkın bir süredir atomun altındaki, atomdan çok çok daha küçük parçacıkları araştırıyor.
Mesele boyutu değil

Öncelikle şu ölçek sorununu çözelim. Tamam, bir atomu en iyi optik mikroskoplarla bile göremiyoruz belki ama yine de atom, fizikçilerin bugün üzerinde çalıştığı birçok şeyden muazzam derecede büyük. Örneğin bizler birer proton olsaydık bir atom bizden yüz binlerce kat büyük olacaktı. Yüz bin proton sıra halinde dizilsek, atomun çapına ancak ulaşabilirdik. Ama insanız ve bir atom bizden on milyar kez daha küçük. Yüz bin atom yan yana sıralansa bir kitap sayfasının kalınlığına ulaşamıyor. Her neyse, atom en küçük parçacık falan değil, büyüklük de göreli anlayacağınız…
Bir önyargıyı parçalamak atomdan zor

20. yüzyıla kadar varlığı büyük oranda halen felsefi spekülasyonlara konu olan atomun varlığının kanıtlanmasında karşımıza yine Einstein çıkıyor. Einstein’ın ilk büyük keşfi bir sıvıda asılı kalan küçük parçacıkların Brown Hareketi adı verilen rasgele kesintisiz hareketinin gizemini çözmesiydi. Mikroskopla görülebilen bu parçacıkların her yönden atom ve moleküllerin rastgele darbelerine maruz kaldığını tespit etti. Görünmeyen atomlar görülebilen daha büyük parçaları itip sallayarak varlıklarını gösteriyordu. Böylece 1905 yılında atomların varlığı bilimsel olarak ispatlandı.
Kuarkları meseleye katmayalım
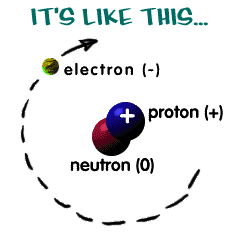
Son söyleyeceğimizi baştan söyleyelim: Atomun içinde elektronlar, protonlar, nötronlar ve (nasıl baktığınıza bağlı tabii ama) bol bol boş alan var.
Elektronun keşfi

Bu üçlüden ilk keşfedilen elektron oldu. Eski Yunanda kehribarı ovuşturunca statik elektrikle yüklendiği biliniyordu. Elektron kelimesi de Yunancada kehribar anlamına geliyor. Eksi (-) yüke sahip bu temel parçacık ilk kez 1897 yılında keşfedildi. Başlangıçta elektronun atomun içinde yer alıp almadığı kesin olarak bilinmiyordu ama buna inanmak için yeterli sebep vardı. Bir kere atoma göre çok daha küçük olduğu bilindiğine göre mantıksal olarak atomu oluşturan parçalardan biri olarak görülebilirdi. İkincisi bilim insanları atomların ışığı soğurduğunu biliyorlardı ve bu bilgiyi elektronların atomların içinde titreştiğine kanıt olarak gördüler.
Elektrona da büyük mü diyorsunuz!
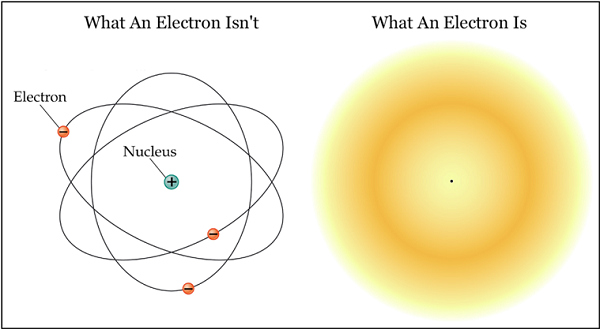
Elektron ne kadar büyük? Olabilecek en küçük büyüklükte! Hatta büyüklüğü yok diyoruz. İçinde bir şey var mı? Hayır, alt bileşenleri olmadığı da kesin. Ama kütlesi, elektrik yükü ve spini var. Peki, bir parçacığın nasıl olup da kütlesi olmasına karşın büyüklüğü olmadığını, elektrik yükü ve spini olmasına karşın büyüklüğü olmadığını sorabilirsiniz. Bir şey büyüklüğü olmadan nasıl var olabilir? Burada çeşitli kuantum kuramlarının farklı açıklamaları var. Net olarak söyleyebileceğimiz, deneye dayanarak şu: Elektron bir büyüklüğe sahipse, bu büyüklük en iyi halde bile protondan binlerce kere küçük, atomdansa yüz milyonlarca kere küçüktür.
Elektronlar olmasaydı yanmıştık

Elektronun bir sicim zerresi mi, dağınık bir olasılık dalgası şeklindeki bir alan mı, sanal refakatçileri olan noktasal bir parçacık mı olduğu yönündeki kuramsal tartışmaları bir kenara bırakalım, her şeyden önce dostumuz elektronun pratik değerini teslim edelim. Elektronların hareketi olmasa ışığın yayılması olmazdı. Bu hem Güneş yüzeyi hem de başucu lambamız için geçerli bir değişmez. Elektronlar olmasaydı göremezdik. Çünkü elektronlar gözümüzün retinasındaki moleküllerin içinde ışığı emerek görmemizi sağlıyor. Makinelerde, jeneratörlerde, yüksek gerilim hatlarında, bilgisayarlarda ve akıllı telefonlarda, ev aletlerinde sanayi çağının esas işini yüklenen hep elektronlardır. Ve en önemlisi yaşayan her hücrenin içinde yaşam enerjisini sağlayan yine elektronların değiş tokuşudur.
Rutherford sağ olsun
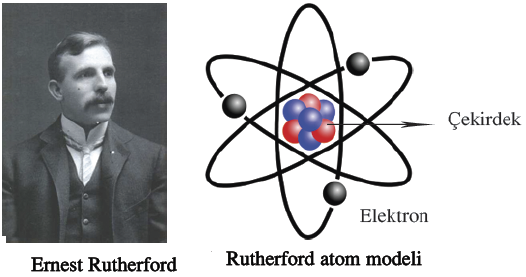
Atom toplamda yüksüzdü, peki eksi (-) yük varsa bunu dengeleyecek artı (+) yük neredeydi? 1911 yılında iri yapılı, şen şakrak Yeni Zelandalı bir bilimci olan Ernest Rutherford, Manchester Üniversitesi’nde asistanlarıyla bir deney yaptı. İnce altın bir folyonun üzerine radyoaktif bir kaynaktan çıkan alfa parçacıklarını gönderip bunların folyodan geçtikten sonra ne yöne sapacağını kaydeden ölçümler yaptılar. Ufak tefek sapmalar beklerken karşılaştığı durumdan nutku tutuldu: “Bir havan topu ince bir kâğıt parçasına ateşlendikten sonra top mermisinin kâğıda çarpıp dönerek sizi vurması kadar olağanüstü bir şeydi bu.” Bazı parçacıkların geri dönmesinin nedeni, atomun pozitif yükünün atomun merkezindeki küçük bir alanda toplaşmış olmasıydı. Atomun merkezinde çok yoğun bir artı yüklü çekirdek vardı ve bu çekirdek hesaplamalarına göre atomun toplam büyüklüğünden en az binlerce kez küçüktü. İşte atomun çekirdeğindeki artı (+) yük taşıyan bu parçacıklara proton adını veriyoruz. Bir protonun kütlesi elektronun kütlesinin 1.836 katıdır.
Üzerimizden bir yük kalkıyor
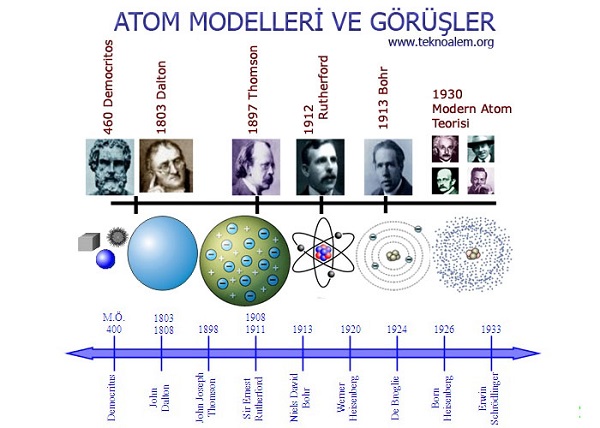
Rutherford’un keşfinin ardından 20 yıl boyunca fizikçiler genellikle çekirdeklerin elektronlar ve protonlardan oluştuğunu varsaydılar. Protonlar gerekli kütleyi veriyor, elektronlar da protonların elektrik yükünü dengeliyordu. Ama bu modelde epey sıkıntı vardı. Sorunu 1932 yılında James Chadwick’in nötronu bulması çözdü. Böylece elektronları çekirdekten süpürmüş olan fizikçiler rahat bir nefes aldı. Çekirdekler protonlar ve nötronlardan oluşmaktaydı. Bunların ortak ismine de nükleon dendi. Protonlar ve nötronlar çekirdeğin içerisinde yan yana dolaşıyorlar, ama sıkça eş değiştiriyorlardı. Daha sonra bu parçacıkların da kuarklardan oluştuğunu öğrenecektik.
Çekirdeğin büyüklüğü
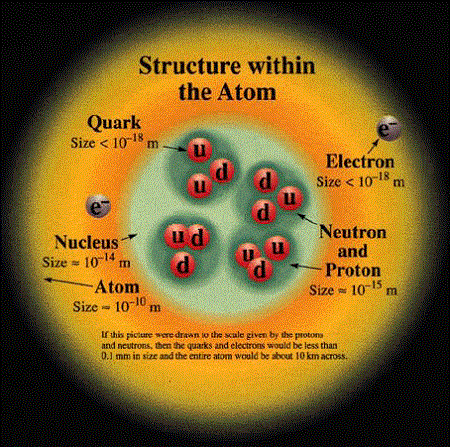
Çekirdeklerin büyüklüğü neye bağlıdır? İçerisindeki nükleonların sayısına. Bütün çekirdekler de yuvarlak değil. Bazıları biraz daha yayvan, az sayıdaki diğerleri ise krep gibi yassı. Çekirdeğin içerisindeki bir proton kendi etrafında hızlı dönüşüyle bir manyetik alan yaratan bir metrenin milyarda birinin milyonda biri büyüklüğünde, pozitif elektrik yüklü bir top. Nötronun boyutları da hemen hemen aynı. Nötronun toplamda bir elektriği yok, ancak hiç yüksüz de değil, içinde birbirini dengeleyen pozitif ve negatif yükler var.
Bir de boş mekân var
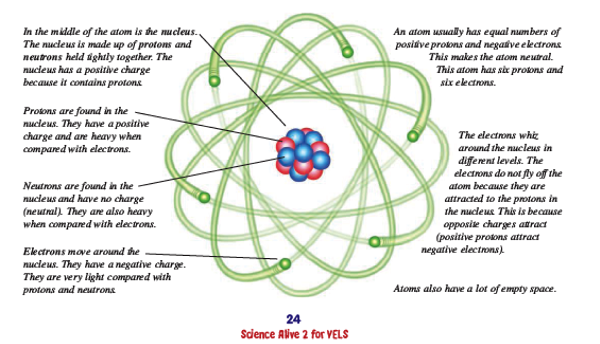
Son olarak boş mekâna gelirsek… Atomun iç kısmına bakmanın iki yolu var. Birinci yol, küçücük elektronların çekirdeğin çevresinde boş bir mekânda hızla döndüğünü kafanızda canlandırmak. Güneşin yörüngesindeki gezegen ve astroidler gibi. Ancak sorun elektronların gezegen olmaması; elektronlar atomun içerisinde olasılık dalgaları biçiminde dağılım gösteriyor. Bu elektron ortamı çekirdeği sarıyor. Bu anlamıyla atomun tam manasıyla bir dış yüzeyi ya da kenarı yok. Yüksek hızlı bir alfa parçacığına atom boş gibi görünüyor. Ancak bir atom bir başka atoma katı bir topmuş gibi davranıyor. Diyelim ki bir atomu bir başka atoma yuvarladınız, yollanan atom diğerinden sekip dönerek uzaklaşıyor. Anlayacağınız atomlara kurşun atmak serbest, ama büyük bir cisim atarsanız bilardo topu muamelesi oluyor. Bunu 1. Dünya Savaşı’ndaki pilotların makineli tüfek kurşunlarını dönen pervanelerin arasından sorunsuzca ateşlemesine benzetebiliriz. Kurşun yerine bilardo topu atsalar, top paramparça olurdu veya çarpıp geri dönerdi.